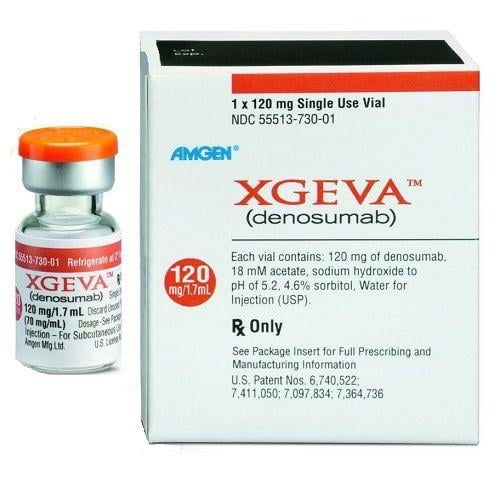
Іксджева Деносумаб 70 мг/мл N1 розчин для ін'єкцій
- Все про товар
- Залишити відгук
- Аналоги і замінники
| Транспортна компанія | ||
- Оплата
- Гарантія
- Умови повернення
Готівкою при отриманні, оплата картою на сайті, накладений платіж
Опишіть симптоми або потрібний препарат — ми допоможемо підібрати його дозування чи аналог, оформимо замовлення з доставкою додому або просто проконсультуємо. Ми — це 28 фармацевтів і 0 ботів.
Так ми завжди будемо з вами на зв'язку і зможемо поспілкуватися в будь-який момент.
Опишіть симптоми або потрібний препарат — ми допоможемо підібрати його дозування чи аналог, оформимо замовлення з доставкою додому або просто проконсультуємо. Ми — це 28 фармацевтів і 0 ботів.
Так ми завжди будемо з вами на зв'язку і зможемо поспілкуватися в будь-який момент.
Властивості препарату Іксджева Деносумаб 70 мг/мл N1 розчин для ін'єкцій
Основні
| Кількість в упаковці | 1 |
| Код АТС/ATX | M05B X04 |
| Об'єм | 1.7 мл |
| Дозування | 70 мг/мл |
| Форма випуску | Розчин для ін'єкцій |
Залишити відгук
Іксджева Деносумаб 70 мг/мл N1 розчин для ін'єкцій - Інструкція для застосування
Інструкція про застосування
медичного імунобіологічного препарату
ІКСДЖЕВА™ / XGEVA™
Деносумаб
Склад:
діюча речовина: деносумаб;
1 флакон (1,7 мл) містить 120 мг деносумабу (70 мг/мл);
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: прозорий, безбарвний або жовтуватий розчин, що може містити незначну кількість від напівпрозорих до білих білковоподібних часток.
Фармакотерапевтична група. Лікарські засоби для лікування захворювань кісток. Інші лікарські засоби, що впливають на структуру та мінералізацію кісток.
Код АТХ М05В Х04.
Імунологічні і біологічні властивості.
Фармакодинаміка.
Механізм дії.
RANKL існує як трансмембранний або розчинний білок. RANKL необхідний для утворення, функціонування та виживання остеобластів - єдиного типу клітин, відповідальних за резорбцію кісток. Підвищена активність остеокластів стимулюється RANKL – головним медіатором деструкції кісток при їх метастатичному ураженні та мієломній хворобі. Деносумаб – це людське моноклональне антитіло (IgG2), яке з високою афінністю та специфічністю направляється та зв’язується з RANKL, попереджаючи виникнення взаємодії RANKL/RANK і призводячи до зниження кількості та послаблення функції остеокластів, таким чином зменшуючи резорбцію та деструкцію кісток, індуковану раком.
Гігантоклітинні пухлини кісток характеризуються експресією ліганду RANK неопластичними стромальними клітинами та RANK остеокластоподібними гігантськими клітинами. У пацієнтів з гігантоклітинною пухлиною кісток деносумаб зв’язується з лігандом RANK, суттєво зменшуючи кількість або елімінуючи остеокластоподібні гігантські клітини. Як наслідок, зменшується остеоліз і проліферативна пухлинна строма заміщується непроліферативною диференційованою щільнотканинною новою кісткою.
Фармакодинамічні ефекти.
В клінічних дослідженнях фази ІІ серед пацієнтів з пізньою стадією злоякісних пухлин, які вражають кістки, підшкірне (п/ш) введення препарату Іксджева кожні 4 тижні або кожні 12 тижнів призводило до швидкого зниження маркерів резорбції кісток (uNTx/Cr, сироватковий CTx) із середнім зниженням на рівні приблизно 80% для uNTx/Cr, яке виникало протягом 1 тижня незалежно від попереднього лікування біфосфонатом або від вихідного рівня uNTx/Cr. В клінічних дослідженнях фази ІІІ середнє зниження на рівні приблизно 80% підтримувалося для uNTx/Cr через 3 місяці після початку лікування у 2075 пацієнтів із пізньою стадією раку, які отримували препарат Іксджева та не отримували внутрішньовенно біфосфонат.
Імуногенність.
В клінічних дослідженнях не було виявлено нейтралізуючих антитіл до препарату Іксджева. При застосуванні імуноферментного аналізу <1% пацієнтів, які отримували деносумаб до 3 років, були позитивними щодо не нейтралізуючих зв’язуючих антитіл без доказів порушеної фармакокінетики, токсичності або клінічної реакції.
Клінічна ефективність у пацієнтів з метастазами солідних пухлин в кістки.
Ефективність та безпечність препарату Іксджева в дозі 120 мг після підшкірного введення кожні 4 тижні або золедронової кислоти в дозі 4 мг (корекція дози при погіршеній функції нирок) після внутрішньовенного введення кожні 4 тижні порівнювалася в трьох рандомізованих, подвійних сліпих активно контрольованих дослідженнях, у пацієнтів, які раніше не отримували внутрішньовенно біфосфонат і мали пізню стадію злоякісної пухлини з ураженням кісток: дорослі з раком молочної залози (дослідження 1), інші солідні пухлини або мієломна хвороба (дослідження 2) та рак передміхурової залози, резистентний до кастрації (дослідження 3). Пацієнти з ОНЩ в анамнезі або остеомієлітом кісток щелепи, пацієнти з активним захворюванням зубів або щелеп, яким необхідне стоматологічне хірургічне втручання, пацієнти, у яких не загоїлися рани після стоматологічного втручання/хірургічне втручання в ротовій порожнині або пацієнти з будь-якими запланованими інвазивними процедурами не були придатними для включення в ці дослідження. Первинні та додаткові кінцеві точки оцінювали появу однієї або більше кісткових подій (КП). В дослідженнях, які демонструють більшу ефективність препарату Іксджева в порівнянні із золедроновою кислотою, пацієнтам пропонувався відкритий режим застосування препарату Іксджева в попередньо визначеній 2-річній розширеній фазі лікування.
Результати дослідження ефективності у пацієнтів з пізніми стадіями злоякісних пухлин, які уражають кістки
Примітки:
НД = не досягнуто; ДВ = дані відсутні; ГКЗ = гіперкальціємія при злоякісній пухлині; ПКП = поширеність кісткових подій; ВР = відношення ризиків; ЗВР = зниження відносного ризику; † - скореговані р-значення представлені з дослідженнь 1, 2 та 3 (перша КП, а також кінцеві точки першої та наступних КП); * - враховує всі кісткові події в динаміці; підраховуються тільки події, які виникли через ≥21 день після попередньої події; ** - включаючи НДРЛ (недрібноклітинний рак легень), нирково-клітинний рак, колоректальний рак, дрібноклітинний рак легень, рак сечового міхура, рак голови та шиї, рак ШКТ/сечостатевої системи та інших локалізацій, за виключенням раку молочної залози та раку передміхурової залози.
N = кількість рандомізованих пацієнтів
Прогресування захворювання та загальна виживаність.
Прогресування захворювання було аналогічним між групами препарату Іксджева та золедронової кислоти в усіх трьох дослідженнях та в попередньо визначеному об’єднаному аналізі трьох досліджень
Вплив на біль
Дослідження болю включали оцінку змін у порівнянні із вихідним рівнем відносно до балу, що відповідає найсильнішому болю за шкалою BPI-SF, оцінку часу до посилення болю, біль від середнього до сильного або припинення болю; а також частку пацієнтів, які задовольняли цим критеріям. У спеціальному (ad-hoc) аналізі об'єднаних даних середній час до посилення болю (збільшення > 4 балів за шкалою вимірювання болю та >2 балів у порівнянні із початковим показником) був тривалішим для препарату Іксджева™у порівнянні із золедроновою кислотою (65 та 59 днів і 181 та 169 днів, відповідно). У додатковому спеціальному аналізі у підгрупах пацієнтів, які відчували помірний біль або зовсім не відчували болю у порівнянні із початковим показником, час до посилення болю (> 4 балів, що відповідає найсильнішому болю) збільшився у групі лікування препаратом Іксджева™у порівнянні із групою лікування золедроновою кислотою (198 та 143 днів відповідно). Час до послаблення болю (тобто, послаблення на >2 бали у порівнянні із початковим показником, що відповідає найсильнішому болю за шкалою BPI-SF) був подібним для деносумабу та золедронової кислоти у кожному дослідженні та за результатами інтегрованого аналізу.
Загальна виживаність та прогресування захворювання
Характер прогресування захворювання був подібним для хворих, які отримували препарат Іксджева™ або золедронову кислоту у всіх трьох дослідженнях та у попередньо планованому об'єднаному аналізі всіх трьох досліджень.
У всіх трьох дослідженнях загальна виживаність була схожою у пацієнтів із розповсюдженими злоякісними пухлинами із ураженням кісток, які приймали препарат Іксджева™або золедронову кислоту: пацієнтки із раком молочної залози (співвідношення ризиків та 95% ДІ 0,95 [0,81, 1,11]), пацієнти із раком передміхурової залози (співвідношення ризиків та 95% ДІ 1,03 [0,91, 1,17]), та пацієнти із іншими солідними пухлинами чи множинною мієломою (співвідношення ризиків та 95% ДІ 0,95 [0,83, 1,08]). У спеціальному аналізі дослідження 2 (пацієнти із іншими солідними пухлинами або множинною мієломою) була проаналізована загальна виживаність при трьох видах пухлин, що використовуються для стратифікації (недрібноклітинний рак легень, множинна мієлома та ін.). Загальна виживаність була більшою для препарату Іксджева™при недрібноклітинному раку легень (співвідношення ризиків [95% ДІ] 0,79 [0,65, 0,95]; n = 702) та більшою для золедронової кислоти при множинній мієломі (співвідношення ризиків [95% ДІ] 2,26 [1,13, 4,50]; п = 180); подібною для препарату Іксджева™ та золедронової кислоти при інших видах пухлин (співвідношення ризиків [95% ДІ] 1,08 (0,90,1,30); n = 894). У цьому дослідженні не контролювались прогностичні фактори лікування множинної мієломи. У комбінованому попередньо планованому аналізі досліджень 1, 2 та 3, загальне виживання було подібним для препарату Іксджева™ та золедронової кислоти (співвідношення ризиків 95%, ДІ 0,99 [0,91, 1,07]).
Дані доклінічних досліджень безпеки
Канцерогенність
Канцерогенний потенціал деносумабу не оцінювався у довготривалих дослідженнях на тваринах.
Мутагенність
Генотоксичний потенціал деносумабу не оцінювався.
Репродуктивна токсикологія
Фертильність
Деносумаб не мав жодного впливу на фертильність самок чи на репродуктивні органи самців мавп при дозах, що в 9,5-16 разів перевищували дозу для людини - 120 мг підшкірно один раз кожні 4 тижні, відповідно.
Фармакологічні дослідження на тваринах
Деносумаб виявився потужним інгібітором резорбції кісткової тканини шляхом інгібування ліганду RANK.
Оскільки біологічна активність деносумабу у тварин є специфічною для приматів, оцінка генетично модифікованих (нокаутних) мишей чи використання інших біологічних інгібіторів шляху RANK/ліганд RANK, наприклад, OPG-Fc та RANK-Fc, використовувалися для оцінки фармакодинамічних властивостей деносумабу у гризунів. У моделях мишей із кістковими метастазами естроген рецептор-позитивного та негативного раку молочної залози, раку передміхурової залози та недрібноклітинного раку легень людини, OPG-Fc зменшував остеолітичні, остеобластичні та остеолітичні/остеобластичні руйнування, затримував формування нових кісткових метастазів та стримував ріст пухлин в кістках. Спостерігалося додаткове інгібування росту пухлин в кістках при комбінації OPG-Fc із гормональною терапією (тамоксифен) у моделях раку молочної залози або в комбінації із хіміотерапією (доцетаксел) на моделях раку передміхурової залози та легень. У моделях мишей із індукуванням росту пухлини молочної залози RANK-Fc затримував формування пухлини.
Примати підліткового віку, які отримували деносумаб у дозах, що в 15 разів (50 мг/кг) та в 2,8 разів (10 мг/кг) перевищували дози під кривою "концентрація-час" (AUC) у дорослих пацієнтів-людей, які отримували 120 мг підшкірно кожні 4 тижні, мали порушення зони росту, що відповідає фармакологічним властивостям деносумабу.
У новонароджених яванських макак, які в матці піддавалися впливу деносумабу 50 мг/кг, мала місце постнатальна смертність; порушення росту кісток, що призводило до зниження міцності кісток, зниження гематопоезу та зміщення зубів; відсутність периферичних лімфатичних вузлів; та зниження неонатального росту. Після періоду відновлення від народження до віку 6 місяців, ефекти з боку кісток повернулись до норми; не було ніяких побічних ефектів під час прорізування зубів; у однієї тварини після відновлення спостерігалась мінералізація від мінімального до помірного рівня в багатьох тканинах. Розвиток молочних залоз у матері проходив нормально.
Нокаутні миші, в яких відсутні RANK чи ліганд RANK, (1) мали відсутність лактації через інгібування дозрівання молочних залоз (лобуло-альвеолярний розвиток залоз під час вагітності) (2), демонстрували порушення формування лімфатичних вузлів (3), зменшення росту кісткової тканини, порушення зон росту та відсутність прорізування зубів. Уповільнення росту кісткової тканини, порушення зон росту та порушення прорізування зубів спостерігалося в дослідженнях у новонароджених щурів, які отримували інгібітори ліганду RANK, ці зміни були частково зворотними після припинення отримання інгібіторів ліганду RANK (див. розділ „Вагітність та лактація ").
Дослідження розподілу в тканинах продемонстрували, що деносумаб не зв'язується із тканинами, відомими своєю експресією інших рецепторів суперсімейства фактору некрозу пухлини, включаючи TNF-залежний ліганд, що індукує апоптоз (TRAIL).
ПОКАЗАННЯ ДЛЯ ЗАСТОСУВАННЯ
Препарат Іксджева™показаний для профілактики кісткових подій у пацієнтів із метастатичним ураженням кісток солідними пухлинами.
СПОСІБ ЗАСТОСУВАННЯ ТА ДОЗИ
Спосіб застосування
Препарат має застосовуватися особами, які належним чином володіють методиками ін'єкційного введення.
Дозування
Рекомендована доза препарату Іксджева™ складає 120 мг у вигляді підшкірної ін'єкції один раз кожні 4 тижні в стегно, живіт чи зовнішню поверхню плеча.
Під час курсу лікування пацієнтам слід вживати достатню кількість кальцію та вітаміну D.
Групи пацієнтів
Діти
Препарат Іксджева™ не рекомендується застосовувати у дітей, оскільки безпека та ефективність не була встановлена у пацієнтів дитячого віку. Дослідження на тваринах продемонстрували, що інгібування RANK/RANK-ліганда (RANKL) із утворенням зв'язку остеопротегерину та Fc (OPG-Fc), супроводжується інгібуванням росту кісткової тканини та затримкою прорізування зубів (див. розділ «Дані доклінічних досліджень безпеки»). Таким чином, лікування деносумабом може зашкодити росту кісткової тканини у дітей із відкритими зонами росту та може інгібувати прорізування зубів.
Особи похилого віку
Жодних загальних розбіжностей в профілі безпеки та ефективності між пацієнтами похилого віку та пацієнтами молодшого віку не спостерігалося. Доступні дані з безпеки та ефективності у пацієнтів похилого віку свідчать про відсутність потреби у коригуванні дози (див. розділ «Фармакокінетика: Особливі групи пацієнтів»).
Ниркова недостатність
Доступні дані з безпеки та ефективності свідчать про відсутність потреби у коригуванні дози у пацієнтів з нирковою недостатністю та у відсутності потреби моніторингу функції нирок при лікуванні препаратом Іксджева™ (див. розділ «Фармакокінетика. Особливі групи пацієнтів»).
Пацієнти із тяжкою нирковою недостатністю (кліренс креатиніну < 30 мл/хв.), або які проходять процедури діалізу, перебувають під більшим ризиком розвитку гіпокальціємії. Забезпечення організму достатньою кількістю кальцію та вітаміну D є важливим для таких пацієнтів, що страждають від тяжкої ниркової недостатності або проходять процедури діалізу.
Печінкова недостатність
Безпечність та ефективність препарату Іксджева™ не досліджувалась у пацієнтів із печінковою недостатністю.
ПОБІЧНА ДІЯ
Дані клінічних досліджень
Побічні реакції реєстрували за класифікацією систем органів MedDRA та за частотою.
Категорії частоти в залежності від річної частоти виникнення наступні:
Дуже часті: ≥1 з 10
Часті: ≥1 зі 100 та < 1 з 10
Нечасті: ≥1 з 1 000 та < 1 зі 100
Рідкі: ≥1 з 10 000 та < 1 з 1,000
Дуже рідкі: < 1/10 000
В кожній групі частоти та класу системи органів представлені небажані ефекти в порядку зменшення серйозності.
ОСОБЛИВОСТІ ЗАСТОСУВАННЯ:
Гіпокальціємія
В клінічних дослідженнях за участі пацієнтів із розповсюдженим раком, які отримували лікування препаратом Іксджева™або золедроновою кислотою, гіпокальціємія виникала частіше у групі лікування препаратом Іксджева™(9,6 %) у порівнянні із групою лікування золедроновою кислотою (5,0 %). Окрім цього, зниження рівнів кальцію в сироватці крові 3 та 4 ступеня спостерігалися частіше у пацієнтів, які отримували препарат Іксджева™, у порівнянні з золедроновою кислотою.
Наявна гіпокальціємія має бути усунена до початку терапії препаратом Іксджева™. Додаткове вживання кальцію та вітаміну D обов'язкове для всіх пацієнтів, окрім випадків наявності г гіпокальціємії. В постмаркетингових спостереженнях повідомлялось про важку симптоматичну гіпокальціємію (див. розділ «Побічна дія»), У разі виникнення гіпокальціємії може знадобитися додаткове короткострокове вживання кальцію (див. розділ «Побічна дія»).
Остеонекроз щелепи (ОНЩ)
Остеонекроз щелепи (ОНЩ) був підтверджений у 1,8% пацієнтів, які отримували препарат Іксджева м, та у 1,3% пацієнтів, які отримували золедронову кислоту (див. розділ «Побічна дія»), У клінічних дослідженнях частота виникнення остеонекрозу щелепи була вищою з довшим періодом експозиції. Обстеження ротової порожнини має бути проведене лікарем, який призначає препарат, до початку лікування препаратом Іксджева™, а також слід розглянути можливість проведення стоматологічного обстеження із належною профілактичною стоматологічною допомогою до початку лікування препаратом Іксджева™ у пацієнтів із факторами ризику ОНЩ. Під час лікування препаратом Іксджева™ слід дотримуватися відповідних правил гігієни порожнини рота. Під час курсу лікування пацієнтам слід за можливості уникати інвазивних стоматологічних процедур. Для пацієнтів, які потребують інвазивних стоматологічних процедур, клінічна оцінка дільничного лікаря та/або стоматолога-хірурга має супроводжувати ведення кожного пацієнта. Пацієнти, в яких підозрюється або в яких розвивається ОНЩ під час курсу лікування препаратом Іксджева™, мають звернутися до стоматолога або стоматолога-хірурга. Атипові переломи кісток
При застосуванні препарату Іксджева™ повідомлялось про атипові переломи кісток. Атипові переломи кісток можуть виникати з або без незначних ушкоджень в підвертлюжній та діафізарній ділянках стегнової кістки і можуть бути білатеральними. Специфічні рентгенологічні дані характеризують ці явища. Про атипові переломи кісток також повідомлялося у пацієнтів із певними супутніми станами (наприклад, нестача вітаміну D, ревматоїдний артрит, гіпофосфатазія) та із застосуванням певних фармацевтичних речовин (наприклад, бісфосфонатів, глюкокортикоїдів, інгібіторів протонового насосу). Ці явища також виникали без антирезорбтивної терапії. Упродовж лікування препаратом Іксджева™пацієнтам рекомендується повідомляти про новий або незвичний біль у стегні, тазостегновому суглобі або паховій частині. Пацієнти з такими симптомами повинні проходити оцінку на наявність неповного перелому кістки, а також їм необхідно пройти обстеження контралатеральної кістки.
Препарати з тією ж діючою речовиною
Препарат Іксджева™ містить ту ж діючу речовину, що й препарат Проліа™ (деносумаб). Пацієнтам, які отримують лікування препаратом Іксджева м, не слід вживати препарат Проліа™.
Взаємодія з іншими лікарськими препаратами та інші форми взаємодії
Дослідження взаємодії з іншими лікарськими засобами не проводилися для препарату Іксджева™.
В клінічних дослідженнях препарат Іксджева™ застосовувався в комбінації з протираковими препаратами та у пацієнтів, які раніше отримували бісфосфонати. Фармакокінетика та фармакодинаміка деносумабу не змінювалась в результаті супутньої хіміотерапії та/або гормональної терапії чи попереднього внутрішньовенного застосування бісфосфонатів. Несумісність
Цей медичний препарат не можна змішувати з іншими медичними препаратами.
Вагітність та лактація
Вагітність
Достатні дані про застосування препарату вагітними жінками відсутні. Препарат Іксджева™ не рекомендується до застосування вагітними жінками.
При дозах у площі під кривою "концентрація-час", що перевищують дозу для людини максимум у 16 разів (120 мг один раз кожні 4 тижні), деносумаб не демонстрував ознак негативного впливу на фертильність у самок яванських макак (див. розділ «Дані доклінічних досліджень безпеки»),
В дослідженні на яванських макаках, яким вводили деносумаб протягом періоду, еквівалентному першому триместру, при експозиціях AUC, що до 10 разів перевищували дозу у людини (120 мг кожні 4 тижні), не було жодного доказу шкоди для матері або плоду. В цьому дослідженні у плода не перевіряли лімфатичні вузли.
В іншому дослідженні на яванських макаках, яким вводили деносумаб протягом вагітності при експозиціях AUC, що в 12 разів перевищували дозу у людини (120 мг кожні 4 тижні), мала місце підвищена кількість народження мертвих тварин та постнатальної смертності; порушення росту кісток, що призвело до зниження міцності кісток, зниження гематопоезу та зміщення зубів; відсутність периферичних лімфатичних вузлів; та зниження неонатального росту. Не було доказів шкоди для матері перед пологами; під час пологів побічні ефекти для матері були не частими. Розвиток молочних залоз у матері проходив нормально. Дослідження на нокаутних мишах вказують на те, що відсутність ліганду RANK може вплинути на розвиток молочних залоз у матері, призводячи до порушення лактації після пологів.
Лактація
Невідомо, чи виділяється деносумаб в грудне молоко. Оскільки деносумаб може потенційно призвести до розвитку побічних реакцій у дітей, яких вигодовують груддю, слід прийняти рішення про те, що саме слід припинити: грудне вигодовування чи прийом препарату.
Вплив на здатність керувати автомобілем та працювати із механізмами
Дослідження впливу на здатність керувати автомобілем та працювати з механізмами не проводилися серед пацієнтів, які приймають деносумаб.
ПЕРЕДОЗУВАННЯ
Дані про перед озування під час клінічних досліджень на людях відсутні.
УМОВИ ЗБЕРІГАННЯ
Зберігати в холодильнику при температурі від 2 до 8° С в оригінальній упаковці для захисту від світла. Не заморожувати. Не струшувати. Зберігати в недоступному для дітей місці. Після вилучення з холодильника зберігати при температурі не вище 25 °С в оригінальній упаковці. Термін придатності після вилучення з холодильнику - 30 днів.
ТЕРМІН ПРИДАТНОСТІ: 36 місяців.
ПАКУВАННЯ
По 1,7 мл розчину (70 мг/мл) в скляному флаконі, виготовленому зі скла 1 типу, що відповідає вимогам Європейської Фармакопеї.
В упаковку вкладають поі флакону разом з інструкцією про застосування.
Зверніть увагу!
Інструкція, розміщена на цій сторінці, носить інформаційний характер і призначена виключно з метою ознайомлення. Не використовуйте цей посібник як медичних рекомендацій .
Постановка діагнозу і вибір методики лікування здійснюється тільки вашим лікарем!
Медмаркет Аптека24 не несе відповідальності за можливі негативні наслідки, що виникли в результаті використання інформації, розміщеної на сайті apteka24.ua. Детальніше про Відмову від відповідальності.
Ціна на Іксджева Деносумаб 70 мг/мл N1 розчин для ін'єкцій актуальна при замовленні на сайті. На apteka24.ua можна купити Іксджева Деносумаб 70 мг/мл N1 розчин для ін'єкцій з доставкою в такі міста України: Київ, Харків, Дніпро, Одеса, Рівне, Біла Церква, Вінниця, Запоріжжя, Івано-Франківськ, Краматорськ, Кременчук, Кривий Ріг, Кропивницький, Львів, Луцьк, Маріуполь, Миколаїв, Полтава, Суми, Тернопіль, Херсон, Житомир, Хмельницький, Черкаси, Чернівці, Чернігів. В інші міста замовлення можуть доставлятися через службу доставки. Доступна доставка кур'єром. Докладніше про способи, вартості та обмеженнях доставки.